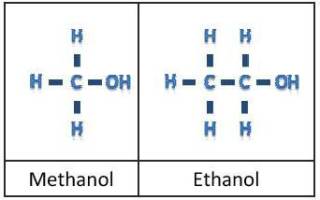
Формула спирта медицинского в химии
Как отличить метиловый от этилового спирта? Формула спирта
Спирт и алкоголь достаточно плотно вошли в нашу повседневную жизнь. В этой статье будут даны основные рекомендации относительно того, как отличить метиловый от этилового спирта. Также будут указаны их характеристики и химические формулы.
История открытия спирта
Формула спирта в том или ином виде была открыта практически одновременно во многих регионах земного шара. В 1334 году французский алхимик Арно де Вильггер изначально получил винный спирт. В 1360 году итальянские и французские монастыри производили такое вещество под названием «вода жизни». Генуэзские купцы в 1386 году привезли спирт в Москву, чтобы продемонстрировать его качества.
Определение
Теперь разберемся с тем, что такое этиловый и метиловый спирт.
Метанол (он же метиловый спирт, он же древесный спирт, он же карбинол, он же метилгидрат, он же гидроксид метила) – одноатомный простейший спирт, ядовитая, бесцветная жидкость. С воздухом образует (в объемных концентрациях от 6,98 до 35,5%) взрывоопасные смеси (при температуре 8 градусов по Цельсию). Молекулярная формула спирта метилового – CH4O или CH3-OH.
Этанол (или же этиловый спирт, или же винный спирт, или же алкоголь, в простонародье просто «спирт», метилкарбинол) – спирт одноатомный с привычной формулой C2H5OH. При стандартных условиях это летучая, бесцветная, горючая прозрачная жидкость. Является депрессантом – психоактивным веществом, угнетающим центральную нервную систему человека, и действующим компонентом алкогольных напитков.
Сравнение
С позиции определения и химической формулы достаточно просто определить то, как отличить метиловый от этилового спирта. На практике же все не настолько уж и просто.
Если обратится к химии, то можно получить много информации об этих веществах: применении, получении, свойствах, нахождение в природе и т.п. Но давайте вернемся к бытовым вопросам и рассмотрим подробнее, чем отличается метанол от этанола.
Метанол по виду подобен этанолу: бесцветный, с характерным, но более слабым запахом. Это и есть основные свойства метилового спирта. Просто так, к сожалению, эти два вещества очень трудно отличить друг от друга. Только профессиональный химик сможет визуально отличить один вид от другого. Цвет, запах, вкус настолько схожи, что часто эти вещества путают. Последствия такой путаницы чреваты: от слепоты до летального исхода.
Отличия
В домашних условиях можно провести несложные опыты для выявления отличий. Приведем три важных способа отличия метанола от этанола. Эти же способы будут носить и сравнительный характер.
1 способ. Поджигание исследуемой жидкости. Один из самых простых и надежных способов: поджигаем наш образец, следим за цветом пламени. Этанол горит синим цветом, а метанол – зеленым. Это же так просто и понятно, но помните, что незнание, к сожалению, не освобождает человека от последствий.
Введем новое понятие в нашей статье – технический спирт. Под понятием «технический спирт» понимаем спирты (метанол, денатурат) и их смеси, не пригодные для употребления человеком, наносящие серьезный и непоправимый урон как здоровью, так и жизни.
Также нужно учесть следующий момент: используя градусник в нашем простом опыте, надо зафиксировать температуру закипания, так как известно из разделов химии, что этанол закипает при температуре 78° по Цельсию, а метанол достигает кипения уже при 64°.
2 способ. Используем обыкновенный картофель. Небольшую дольку картофеля на несколько часов нужно бросить в исследуемую жидкость: если по истечении указанного времени картофель не поменял цвет, то перед вами этанол – вещество, пригодное для употребления. Если же долька картофеля окрасилась в розовый цвет, то исследуемая жидкость является метанолом – сильнейшим ядом для организма человека.
3 способ. Формальдегидная проба. Здесь нам понадобится медная проволока, небольшую часть которой необходимо накалить добела и опустить в жидкость. При нахождении в ней этанола можно почувствовать запах прелых яблок, а там, где находится метанол, вы услышите резкий неприятный запах – запах формальдегида.
Помните, что небольшая доза (хватает и 50 мл) метанола может привести к смертельному исходу. Будьте бдительны, не покупайте алкогольные напитки в сомнительных точках продаж, не рискуйте жизнью и здоровьем, а покупайте алкоголь в специализированных магазинах.
Симптомы отравления метанолом
Симптоматика отравления метанолом очень схожа с алкогольным отравлением, но на общем фоне тошноты, головокружения, опьянения, вялости, рвоты, судорог необходимо выделить потерю зрения. Метанол попадает в организм человека во время дыхания, через кожу и пищеварительный тракт. Возникает сильнейшая боль в ногах, резкая головная боль. Он поражает нервную систему, разрушает сосуды, приводит к слепоте. Быстро всасывается, медленно выделяется, кумулирует (накапливается). Окисляясь в организме, образует токсичные соединения – муравьиную кислоту и формальдегид. Формальдегид является очень токсичным, так как это вещество первого класса опасности. Он официально признан концерагеном. Накопление его в организме приводит к развитию онкологических заболеваний. Муравьиная кислота вызывает повреждение глаз и дыхательных путей. Тяжелое отравление с потерей зрения может вызвать прием внутрь всего лишь 5-10 мл метилового спирта. Смертельная доза находится в пределах от 30 до 100 мл, но она зависит и от индивидуальных особенностей конкретного организма. Смерть наступает от остановки дыхания. Диагноз может быть подтвержден нахождением в моче пострадавшего такого вещества, как муравьиная кислота.
Первая медицинская помощь
Выше было наглядно показано как отличить метиловый от этилового спирта. Однако бывают в жизни такие ситуации, когда приходится оказывать пострадавшему первую медицинскую помощь. При отравлении метанолом она направлена на выведение из организма яда, задержку процесса окисления данного вещества. Однако в самую первую очередь будет страдать выделительная система. При употреблении технического спирта внутрь, необходимо промыть желудок в течении пары первых часов. Обычно назначают обильное питье, прием растворов щелочей (гидрокарбоната натрия 10-15 грамм). Противоядием является этиловый спирт, который понижает процесс окисления метилового спирта и образование токсических продуктов превращения. Статистика по случаям отравления метанолом удручающая.
Этиловый спирт. ГОСТ
ГОСТ – это прежде всего документ, регламентирующий какими качествами должны обладать товары, продаваемые на территории определенной страны. Существует несколько ГОСТов на этанол, которые описывают предназначение, условия хранения, транспортировки и многое другое.
Но такой сложный вопрос, как употребление алкогольных напитков, может породить многочасовые дебаты. Да и не в этом дело, ведь каждый человек должен сам для себя решать вопросы подобного уровня. Но давайте обратимся к ГОСТу 1972 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом. Относится к сильнодействующим наркотикам, которые вызывают сначала возбуждение, а затем – паралич нервной системы».
Теперь читаем ГОСТ 1982 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом, относящаяся к сильнодействующим наркотикам». И, наконец, 2000 год: «Этиловый спирт – это бесцветная, легковоспламеняющаяся жидкость с характерным запахом». Эти же самые нормативные документы и регламентируют такое вещество, как спирт этиловый технический.
Вред и польза алкоголя
Давайте не будем трогать этот огромный айсберг под названием «пить или не пить». Вспомним слова всеми любимого Семена Семеновича Горбункова о пользе алкоголя. Алкоголь способен незначительно предотвратить формирование тромбов, снизить содержание в крови холестерина, расширить сосуды, что приведет к более интенсивному кровообращению. А лекарство, как известно, любит четкую дозировку, поэтому 50 мл лечит и бодрит. Но польза, которую приносит алкоголь, слишком мала по сравнению с его вредом: алкоголь вносит изменения в генетическую структуру человека, что может привести к отклонениям в умственном развитии потомков, оказывает пагубное действие на нравственное поведение человека. При этом стоит вспомнить, что именно алкоголь побуждает человека совершать необдуманные, глупые и жестокие поступки. Чтобы такого не случилось, следует четко соблюдать норму. Полезным будет и полный отказ от разнообразных алкогольных напитков.
Помните, что если вы превысите норму, то алкоголь станет ядом, который нанесет вред органам и даже целым системам вашего организма.
Собственно на этом и можно закончить рассуждение о том, как отличить метиловый от этилового спирта.
Этанол (этиловый спирт): применение, можно ли его пить, действие
Этанол – это вещество, обладающее специфическим ароматом и вкусом, которое впервые было получено при помощи реакции брожения. Для этого метаболического процесса применялись разнообразные продукты: злаки, овощи, ягоды. Впоследствии были освоены дистилляционные процессы и методы получения раствора с более высокой концентрацией спирта.
Этанол (как, собственно, и его аналоги) стал широко востребован из-за ряда своих свойств. Во избежание опасного влияния на организм необходимо выяснить, какими особенностями обладает это вещество и какова специфика его использования.
Этанол – что это такое
Этанол, который также называют винным, или этиловым спиртом, представляет собой одноатомный спирт. Это означает, что в его состав входит один-единственный атом. Название вещества на латыни звучит как Aethanolum. Формула этанола – C2H5OH. Данный спирт используется в самых разных областях: косметологической, фармацевтической, косметологической, промышленной. Градус его может варьироваться.
Этиловый спирт лег в основу производства разнообразной алкогольной продукции благодаря способности его молекулы угнетать центральную нервную систему.
По нормативным документам этиловый ректификованный спирт имеет ГОСТ 5962-2013. Необходимо отличать его от технической вариации жидкости, которая получила применение главным образом в промышленной сфере. Производство и хранение спиртосодержащих напитков строго контролируют гос.органы.
Чем вреден и полезен этиловый спирт
Если употреблять этанол в малых дозах, он оказывает полезное влияние на организм человека. Отпускается он исключительно по рецепту врача. Стоимость зависит от объема емкости.
Этиловый спирт оказывает следующее положительное действие:
- является профилактическим средством для борьбы с заболеваниями миокарда;
- разжижает кровь;
- нормализует функционирование желудочно-кишечного тракта;
- улучшает кровоснабжение;
- уменьшает болевые ощущения.
Если регулярно употреблять этиловый спирт, в организме может начаться кислородное голодание. Клетки головного мозга стремительно погибают, в результате чего ухудшается память и концентрация внимания, снижается болевой порог.
Злоупотребление алкогольными напитками чревато сильной интоксикацией и наступлением коматозного состояния. Спирт вызывает не только физическую, но и психическую зависимость. Если не будут приняты необходимые лечебные меры и человек не перестанет употреблять алкогольные напитки, произойдет деградация личности, нарушение полноценных общественных связей.
Свойства
Этиловый спирт является естественным метаболитом за счет своей способности синтезироваться в человеческом организме.
Свойства этанола можно условно разбить на три группы:
В первую группу включено описание внешнего вида и прочих физических параметров. В нормальных условиях винный спирт проявляет летучие свойства, выделяется среди остальных веществ специфическим запахом и жгучим вкусом. Один литр жидкости весит 790 г.
Этанол хорошо растворяет разные органические вещества. Закипает он при температуре 78,39 °C. Этиловый спирт обладает меньшей плотностью, чем вода (согласно измерению ареометром), вследствие этого он легче ее.
Этанол представляет собой горючее, быстровоспламеняющееся вещество. При возгорании пламя имеет синий цвет. Из-за этого химического свойства не составляет труда отличить этиловый спирт от метилового, который является ядом для человека. Пламя метилового спирта при горении обладает зеленым цветом.
Винный спирт – это пожароопасное вещество, поскольку воспламеняется при температуре в 18 °С. По этой причине во время контакта с этанолом нельзя допускать его нагревания.
Чрезмерное употребление этанола губительно для организма, что обусловлено теми механизмами, которые запускает прием какого бы то ни было алкоголя. Смешение воды со спиртом способствует выделению эндорфина, именуемого в простонародье «гормоном счастья».
Из-за этого оказывается седативно-гипнотическое воздействие, иными словами, подавление сознания. Последнее обнаруживается в превалировании процессов торможения, проявляющихся такими признаками, как снижение реакции, замедленность речи и движений.
Историческая справка
Этиловый спирт стали использовать еще в эпоху неолита. Это подтверждают следы спиртосодержащих напитков, разысканные в Китае на керамике, возраст которой насчитывает приблизительно 9 тысяч лет. Винный спирт впервые был получен в 12-м веке в Салерно. Тогда это была водно-спиртовая смесь.
Чистый продукт получил в 1976 году русский ученый Товий Егорович Ловиц. В качестве фильтрационного средства он применил активированный уголь. В течение многих лет это был единственный метод получения спирта.
Затем формулу этилового спирта вычислил швейцарский ученый Николо-Теодор де Соссюр. Описал вещество в качестве углеродного соединения французский химик Антуан Лоран Лавуазье. В 19-20 веках проводилось скрупулезное исследование этанола и было дано подробное описание его свойств. За счет последних он стал широко применяться в самых разных областях человеческой жизни.
Чем опасен этанол
Винный спирт принадлежит к той группе веществ, незнание свойств которых может обернуться отрицательными последствиями. По этой причине прежде, чем применять этанол, необходимо выяснить, чем он может быть опасен.
Этиловый спирт: можно ли его пить
Употреблять этанол в составе спиртосодержащей продукции можно только с соблюдением важного условия – делать это редко и в маленьких дозировках.
Если употреблять алкогольную продукцию в больших количествах (когда концентрация этилового спирта равна 12 г. на 1 кг. веса человека), это вызовет сильнейшее отравление организма, которое при неоказании срочной медицинской помощи может привести даже к смерти.
Какие болезни вызывает винный спирт
При употреблении этилового спирта особенно опасны продукты его распада в организме. К одним из таких ядовитых веществ, вызывающих наследственные изменения – мутации, принадлежит ацетальдегид.
Чем чревато бесконтрольное употребление винного спирта:
- погибают клетки головного мозга;
- развиваются печеночные (цирроз) и почечные заболевания;
- ухудшается память;
- деградирует личность;
- расстраивается работа желудочно-кишечного тракта (язва двенадцатиперстной кишки, гастрит);
- нарушается функционирование сердечно-сосудистой системы (инфаркт, инсульт);
- происходят необратимые процессы в центральной нервной системе.
Применение этанола
Богатый спектр воздействия винного спирта позволяет применять его в различных сферах. Самое широкое распространение он получил в следующих областях:
- В качестве автомобильного топлива
Применение этанола как моторного топлива связано с именем американского промышленника Генри Форда. В 1880 году он изобрел первый автомобиль, работающий на этиловом спирте. Впоследствии это вещество начали применять для работы ракетных двигателей, разнообразных нагревательных приборов, грелок для туристов и военнослужащих.
Сейчас также активно используется бензин Е85 и Е95 на основе биоэтанола, что способствует уменьшению потребления нефтепродуктов, выброса парниковых газов и применения ископаемого топлива.
Таким образом, благодаря использованию автомобильного топлива с полным сгоранием (биоэтанол и его смеси) улучшается экологическая ситуация, поскольку воздух мегаполисов загрязняют преимущественно транспортные выхлопы.
В состав продуктов сгорания бензина входит огромное количество веществ, представляющих опасность для здоровья.
- Фармакологическое производство
В этой отрасли этанол используется по-разному. Дезинфицирующие свойства медицинского спирта допускают его применение для обработки операционного поля, рук врача-хирурга. Благодаря использованию этанола удается уменьшить проявления лихорадки, изготавливать основы для настоек и компрессы.
Винный спирт принадлежит к противоядиям, помогающим при интоксикации этиленгликолем и метанолом. Он также применяется как пеногаситель при подаче кислорода либо искусственной вентиляции легких.
Так что этиловый спирт является незаменимым веществом в медицине как для наружного применения, так и для использования в качестве питьевой жидкости.
- Химическая отрасль
Используя этанол, получают другие вещества, к примеру, этилен. Поскольку винный спирт является превосходным растворителем, он получил применение в производстве лакокрасочной продукции, средств бытовой химии.
- Пищевая индустрия
Этанол служит основным компонентом алкогольных напитков. Он входит в состав продуктов, полученных посредством процессов брожения. Этиловый спирт применяют в качестве растворителя всевозможных ароматизаторов и консерванта при производстве хлебобулочных и кондитерских изделий. Он также служит пищевой добавкой Е1510.
- Косметическая промышленность
Производители косметических и парфюмерных средств используют этанол для изготовления туалетной воды, духов, шампуней, одеколонов, спреев и другой продукции.
- Иные направления
Этиловый спирт применяется для работы с препаратами, имеющими биологическую природу.
Как взаимодействует с другими веществами
В инструкции по применению указано, что винный спирт при совместном использовании способствует усилению действия лекарственных препаратов, угнетающих дыхательный центр, процессы кровоснабжения, центральную нервную систему.
О взаимодействии этанола с некоторыми веществами можно узнать из таблицы, приведенной ниже.
| Лекарственный препарат | Действие этилового спирта при одновременном использовании |
| Нейролептики | Усиливает эффект медикаментов |
| Противосудорожные | Вызывает эпилептический припадок |
| Анельгезирующие | Появление тяжелой непереносимости лекарств |
| Сердечно-сосудистые | Формирование коллапса, в результате которого резко снижается давление |
| Антикоагулянты | Появление кровотечения и кровоизлияния во внутривенные органы, параличи конечностей, смерть |
В зависимости от применения этиловый спирт может приносить как пользу, так и вред. В результате употребления спиртосодержащей продукции вырабатывается алкогольная зависимость. Вследствие этого использование горячительных напитков в качестве средства для борьбы с депрессией не должно входить в привычку.
© 2018 – 2019, Буната Дмитрий. Все права защищены.
Температура замерзания спирта: формула и плотность этанола, его применение и производство
Каждое вещество имеет свою температуру, при которой переходит из жидкого состояния в твердое.
На нее влияют химические свойства жидкости и уровня атмосферного давления.
Общие сведения
Этиловый спирт – это жидкость, не имеющая запаха, цвета и привкуса. Впервые синтез этилового спирта (этанола, ethanol, метилкарбинол, метиловый спирт) произошел в середине XIX века.
Состав этанола отражается в его химической формуле — С2Н60, структурная формула имеет вид СН3СН2ОН. Из формулы видно, что этиловый спирт является одноатомным насыщенным веществом и является производным от этана способом замены одного водородного атома на гидроксильную группу ОН.
В связи с этим обусловлены химические свойства этанола, а также его способности вступать в реакцию с молекулами других химических веществ и элементов. При хранении безводного спирта стоит учесть гигроскопичность вещества. Если емкость с жидкостью недостаточно герметична, то он не только испаряется, но и поглощает влагу снаружи, что понижает крепость спирта.
Так как метилкарбинол имеет похожее строение с водой и содержит мало атомов углерода, то он прекрасно смешивается с H2O, не зависимо от пропорций. Этот спирт также является производным таких веществ как вода и ethanol.
Этиловый спирт легко воспламеняется (при 13 градусах Цельсия) и в процессе горения образует два вещества – H2O и диоксид углерода. Пороги взрываемости составляют +11 °С и — 41°С. Закипает данное вещество при +78,3 градуса Цельсия, а замерзания при 117°С ниже нуля. Жидкость, которая на 40% содержит этанол, замерзает при —28 градусах Цельсия.
При конденсации метилкарбинола на выходе получается вещество, содержащее активный водород. Чем меньше спирта содержится в жидкости, тем выше его температура замерзания.
Пары спирта очень токсичны для организма человека. Санитарными нормами допускается 1 мг/дм 3 содержания паров С3Н2ОН в воздухе.
Требования к сырью
Основная задача производителей алкоголя это производство этанола высокого качества. Согласно госстандартам и законодательным актам к качеству компонентов алкогольных напитков предъявляются строгие требования.
Основными ингредиентами алкогольных напитков является вода и ректификованный этинол, который добывается в процессе биотехнологической переработки сельскохозяйственного сырья. Процесс переработки представляет собой большое количество процессов, влияющих на свойства ethanol.
Органолептические свойства этанола зависят от следующего:
- вида и качества используемого зерна;
- способ помола;
- подготовка сырья к осахариванию;
- дозировка и состояние осахаривающих материалов в процессе гидролиза;
- добавление дрожжей;
- кислотность и длительность процесса брожения;
- использование антисептиков и дезинфицирующих элементов;
- санитария в трубопроводах и в другом оборудовании по производству спирта.
Сельскохозяйственное сырье поступает от разных поставщиков на предприятия по контрактам. Поступившее зерно проходит контроль во время которого определяется его влажность, процент содержания сорняков и крахмала.
На этом этапе не учитываются такие критерии, как кислотность, клейкость, стекловидность и др. Строгий контроль за качеством сырья обусловлен его влиянием на органолептические показатели этанола. Некачественное сырье, зараженное головней, недозрелое зерно или поврежденное сушкой, негативно влияет на органолептические свойства спирта.
Технология производства
Технология производства спирта (нажмите для увеличения)
На сегодняшний день существует три технологии производства этанола:
- ферментативная (биохимическая);
- химическая;
- синтетическая.
При производстве спирта первого типа сахар сбраживают с помощью ферментов, масел и дрожжей, то есть:
Для получения спирта с помощью второго способа технический спирт оказывают химическое воздействие минеральными кислотами на молекулярном уровне.
При использовании третьего способа получения этанола к этилену присоединяют воду в среде с катализатором, то есть:
Ректификованный этиловый спирт изготавливается только из пищевого субстрата. В основном для этого используются зерновые культуры, патока или картофель.
Процесс изготовления спирта состоит из следующих этапов:
- подготовительный – подготовка солода из очищенного сырья;
- основной – разваривание, осахаривание, сбраживание солода, перегон браги и получение сырого этанола;
- завершающий – повторный перегон для очистки этанола от примесей (ректификация).
Полученный ректификованный этиловый спирт разделяют на несколько видов:
- спирт первого сорта;
- базисный;
- экстра-спирт;
- спирт класса люкс;
- альфа-спирт.
Для изготовления водки и других алкогольных напитков используются все виды этанола, кроме первого.
Условия хранения
Хранение этилового спирта осуществляется в специальных герметичных резервуарах, которые пломбируются и опечатываются. Категорически запрещено хранить спирт в оцинкованной таре.
Упакованный спирт имеет специальную маркировку, которая содержит информацию о предприятии изготовителе, название спирта, масса, объем, номер тары и партии.
Помимо этого, на тару наносится информация о легко воспламеняемости жидкости, обозначение стандарта и классификационные шифры. Хранить медицинский спирт можно неограниченный срок.
Применение
Применение спирта (нажмите для увеличения)
Одним из способов применения очищенного спирта является его использование в автомобилях. Для автоводителей температура, при которой этанол замерзает, очень важна в зимнее время.
Еще одно применение этилового спирта – изготовление водки. Однако это не чистый этанол, а с примесью различных органических веществ.
Водка представляет собой водно-спиртовую смесь, которая на 40% состоит из спирта и на 60% из воды. Температура замерзания водки находится в пределах 25-29 градусов мороза.
Это свойство позволяет проверить качество данного спиртного напитка – если температура воздуха выше 25 градусов, а водка замерзла, то качество ее весьма сомнительное.
Другие виды
Кроме этилового спирта существуют и другие спирты, которые применяются в промышленности и быту.
Изоамиловый спирт представляет собой жидкость без цвета и с резким запахом. Температура кипения изоамила составляет 132,1. Пары этого спирта ядовиты и вызывают раздражение слизистых оболочек, приступы кашля и удушье.
Изопропиловый спирт — это прозрачная жидкость, которая имеет резкий запах и горький вкус. Его используют для замены этилового спирта в медицине, изготовлении косметики, парфюмерии и предметов бытовой и автомобильной химии. Изопропиловый спирт легко воспламеняется, а его испарения оказывают токсичное влияние на организм человека.
Благодаря низкой температуре замерзания этанол добавляют в ряд изделий в качестве вещества, снижающего температуру замерзания и препятствующего высыханию, например, как антифриз в авиации.
Температура замерзания этилового спирта зависит от его концентрации. Чем выше процент содержания спирта в растворе, тем ниже температура, при которой жидкость кристаллизируется.
Из чего делается спирт, смотрите в следующем видео:
Формула спирта медицинского в химии
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
o одноатомные (одна группа -ОН)
o многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов – полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
трехатомный спирт – глицерин (пропантриол-1,2,3)
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (- OH )
2. Гомологический ряд
Метиловый спирт
(метанол)
Этиловый спирт
(этанол)
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса “ол”.
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова “спирт“. В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:
· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:
· межклассовая изомерия с простыми эфирами
Например,
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3 C H(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более “кислым” в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
Формула этилового спирта в химии. Химическое использование спирта
Благодаря истории, мы можем узнать многие подробности, касающиеся, нашей обыденной жизни. Давайте обратимся к истокам и выясним кто же впервые открыл формулу этила.
Во многих частях земли химическая формула этилового спирта, была открыта почти в одно время. Кто изобрёл этил, а также этиловый спирт и формулу? Французский алхимик Арно де Вильггер в 1334 году открыл винный спирт. А также было вещество имеющее название «Вода жизни» которую изобрели итальянские и французские монахи в 1360 году.
Также не стоит забывать о том, что в Москву, впервые, этил привезли генуэзские торговцы в 1386 году, дабы продемонстрировать его сильные стороны. Они, конечно, не могли знать, что через несколько столетий, в России введут так называемый Сухой закон.
Вполне вероятно что закон на запрет продажи и употребления алкоголя привнёс много положительных моментов в жизнь тогдашних людей. Хотя бы такие моменты, как уменьшение преступлений, психически нездоровых людей, повышение рождаемости здоровых детей, и увеличение рождаемости в целом, также уменьшилось число самоубийц. Конечно, в самом запрете были и минусы: алкоголь изготовляли тайно – нарушение закона, плюс ко всему ещё и отравление при употреблении суррогатов. Хотелось бы отметить, по моему мнению, полный запрет излишен, но должен быть какой-то предел продажи или подобное этому, необходимо ограничение. А употреблять или нет, это уже вопрос, на который должен ответить каждый себе лично.
Виды спирта
Существует несколько основных видов:
- этиловый (винный);
- метиловый (древесный);
- пентан-1-ол (амиловый);
- гексадекан-1-ол (цетиловый).
Из видео вы узнаете о спиртах и их химических свойствах.
Что же такое этил?
В химии это довольно сложное и запутанное определение, но все же я его помещу сюда, чтобы вы понимали о чём здесь идёт речь.
Спирты – органические вещества, которые содержат одну или несколько гидроксильных групп, непосредственно связанных с атомом углерода, находится в состоянии -гибридизации (насыщенный атом углерода).
Что же такое этиловый спирт?
Этанол (он же этил также известен как винный спирт, мы привыкли считать его просто алкоголем) – одноатомный спирт с очень знакомой нам химической формулой С2Н5ОН. В обычных условиях летучая, не имеющая цвета, легковоспламеняющаяся жидкость. Психоактивное вещество, которое угнетает центральную нервную систему (ЦНС), а также входит в состав алкогольных напитков. Алкоголь вошёл в нашу жизнь уже довольно давно и стал неотъемлемой частью любого праздничного застолья. Употреблять алкоголь или нет, этот спор может затянуться на долгие часы, а то и привести к печальным последствиям. На самом же деле каждый сам вправе и должен решить «пить или не пить, вот в чём вопрос».
В далёком 1880 году, всем известный Генри Форд, изобрёл автомобиль при этом в качестве топлива использовав этанол. В 1902 году также была представлена возможность использования этанола как топливо для автомобилей. Тогда на конкурсе было показано около 70 двигателей которые работали на этаноле и его смеси с бензином, в качестве смешивания топлива использовался карбюратор.
Номенклатура, классификация, изометрия спиртов.
Применение
- В химической промышленности применение этанола, безусловно, весьма широко. Вот некоторые из применений: используется как растворитель (бытовая химия, лакокрасочные изделия); входит в состав антифризов и жидкостей для омывания стёкол; применяется в моющих средствах, и это только немногие применения этанола.
- Спирт применяется в медицине, прежде всего как антисептик. Растворитель всевозможных лекарств. В медицине применение спирта очень важная составляющая и нельзя недооценивать важность этила.
- Используется в парфюмерии как основной компонент духов, одеколонов и аэрозолей. Входит в состав зубных паст, различных шампуней, гелей для душа и т. п.
Бесспорно, необходимо отдать должное Арно де Вильггер, а также другим алхимикам, за то, что они изобрели формулу этила. Применение этила является важнейшим аспектом как в медицине, так и в парфюмерии как производстве, так и в химии. С2Н5ОН – химическая формула спирта, известная практически каждому ещё со школьной скамьи, по крайне мере тем, кто хоть немного, слушал на уроках все, что связано со словом «химический».
Невозможно не затронуть такую тонкую тему вреда и пользы алкоголя. Как многие привыкли считать, алкоголь в небольших дозах полезен, но, к сожалению, доля пользы несопоставима с долей вреда который алкоголь приносит. Из пользы можно выделить незначительное предотвращение формирования тромбоза, что само по себе приводит к хорошему кровообращению. А вот из вредных аспектов выделим то, что алкоголь может внести изменение в генетическую структуру человека, может повлиять на отклонения у новорождённых детей, помимо этого, не стоит и говорить о том влиянии которое алкоголь оказывает на поведение человека.
Больше всего изнасилований и преступлений в целом было совершено в алкогольном опьянении, что в целом полностью говорит о пагубности употребления алкогольных напитков.
В конце статьи, хотелось бы подвести итог. Несомненно, польза этилового спирта неоспорима! Употребление алкоголя это немалый минус, с которым нужно бороться, но борьба начинается с нас самих.